新闻
https://www.medsci.cn/article/show_article.do?id=a349203e1892
简介:衰老的特征是生理能力的逐渐丧失。在细胞水平上,衰老过程的两个关键标志包括端粒长度(TL)缩短和细胞衰老。使用某些高压氧疗法(HBOT)反复进行的间歇性高氧暴露可引起再生效应,这种效应通常在缺氧期间发生。当前研究的目的是评估HBOT是否会影响正常,非病理,老龄成年人口中的TL和衰老细胞浓度。
方法:招募了35名64岁及以上的健康独立生活的成年人,每天接受60次HBOT暴露。全血样品收集基线,在30次和60次,最后HBOT会议之后会话,1-2周。评估外周血单个核细胞(PBMC)端粒的长度和衰老。
结果:HBOT后,T辅助细胞,T细胞毒性,天然杀伤细胞和B细胞的端粒长度显着增加了20%以上。最显著变化是在B细胞,其在30增加注意到次会议上,60个由25.68%±40.42(p值= 0.007),29.39%±23.39(p值= 0.0001)和37.63%±52.73(对会话和交高压氧= 0.007)。
HBOT后衰老的T辅助细胞数量显着减少-37.30%±33.04(P <0.0001)。HBOT后T细胞毒性衰老细胞百分比显着下降-10.96%±12.59(p = 0.0004)。
总之,该研究表明,HBOT可能诱导明显的衰老作用,包括显着增加衰老人群的端粒长度和衰老细胞的清除率。
介绍
衰老的特征是生理完整性的逐渐丧失,导致功能受损以及对疾病和死亡的敏感性。这种生物恶化被认为是尤其是癌症,心血管疾病,糖尿病和阿尔茨海默氏病的主要危险因素。在细胞水平上,衰老过程有两个关键标志:端粒长度的缩短和细胞衰老[ 1 ]。
端粒是位于染色体末端的串联核苷酸重复序列,可维持基因组稳定性。端粒在复制(有丝分裂)过程中会缩短,这是由于固有的无法完全复制落后的DNA链末端的原因[ 2 ]。端粒长度(TL),4至15个碱基之间测量,逐渐缩短每年由〜20-40个碱基,并与不同的疾病,低物理性能和大脑[的皮质变薄相关联3 – 5 ]。当TL达到临界长度时,细胞将无法复制并发展为衰老或程序性细胞死亡[ 6 ]。Goglin等。证明,拥有更短TL的成年人死亡率增加[ 7]。缩短TLS可直接遗传性状,但一些环境因素也与缩短TL包括应激相关,缺乏身体耐力活动,过量身体质量指数,吸烟,慢性炎症,维生素缺乏和氧化应激的2,8,9 ]。
细胞衰老是细胞周期的停滞,这可能是由端粒缩短[ 10 ]以及其他与TL相关的衰老相关刺激(例如非端粒DNA损伤)引起的[ 1 ]。衰老的主要目的是通过触发受损细胞通过免疫系统的清除来防止受损细胞的繁殖。衰老细胞随着衰老的积累反映出这些细胞的生成增加和/或它们的清除率降低,这反过来加剧了损害并加剧了衰老[ 1 ]。
越来越多的研究身体已经发现了几个药理学试剂,可以降低端粒缩短率[ 11,12 ]。几个生活方式干预包括耐力训练,饮食和补充剂靶向细胞代谢和氧化应激已经报道相对小的效果(2-5%)上TL 3, [ 2,8,9 ]。
高压氧疗法(HBOT)在高于一个绝对大气压(ATA)的环境压力下利用100%的氧气来增加溶解在人体组织中的氧气量。重复间歇高氧暴露,使用某些HBOT协议,可诱导通常在高氧环境缺氧时发生,所谓的高氧缺氧悖论[生理效应13 – 16 ]。此外,最近有研究表明,HBOT可以通过涉及脑血流区域变化的机制来诱导健康衰老成年人的认知增强[ 17]。]。在细胞水平上,已证明HBOT可以诱导缺氧诱导因子(HIF),血管内皮生长因子(VEGF)和sirtuin(SIRT)的表达,干细胞增殖,线粒体生物发生,血管生成和神经发生[ 18 ]。但是,迄今为止,尚无研究检查HBOT对TL和衰老细胞积累的影响。
当前研究的目的是评估HBOT是否会影响成年人的TL和衰老样T细胞。
结果
35个人被分配到HBOT。五名患者未完成基线评估,被排除在外。所有完成基线评估的30名患者均完成了干预措施。由于血液样本质量低(细胞数量少或技术人员错误),端粒分析中排除了4例患者,衰老细胞分析中排除了10例患者(图1)。表1提供了患者被排除后的基线特征和队列比较。三组之间无显着差异(表1)。
表1.基线特征。
| HBOT | 端粒分析 | 衰老分析 | P值 | ||
| ñ | 30 | 25(83.3%) | 20(66.6%) | ||
| 年龄(岁) | 68.41±13.2 | 67.56±14.35 | 66.70±16.00 | 0.917 | |
| 体重指数 | 26.77±3.20 | 26.89±3.34 | 27.14±3.81 | 0.946 | |
| 雄性 | 16(53.3%) | 13(52.0%) | 10(50.0%) | 0.987 | |
| 雌性 | 14(47.7%) | 12(48.0%) | 10(50.0%) | 0.987 | |
| 全血细胞计数 | |||||
| 血红蛋白 | 6.33±1.25 | 6.57±1.15 | 6.58±1.29 | 0.707 | |
| 白血细胞 | 14.02±1.40 | 13.92±1.35 | 13.97±1.49 | 0.969 | |
| %PBMC | 39.96±6.75 | 39.25±6.64 | 38.59±6.63 | 0.774 | |
| 血小板 | 239.87±1.39 | 244.08±43.0 | 254.05±41.4 | 0.559 | |
| 慢性病 | |||||
| 心房颤动 | 4(13.3%) | 4(16.0%) | 2(10.0%) | 0.841 | |
| 甲状腺功能减退 | 4(13.3%) | 4(16.0%) | 3(15.8%) | 0.956 | |
| 阻塞性睡眠呼吸暂停 | 4(13.3%) | 4(16.0%) | 3(15.0%) | 0.961 | |
| 哮喘 | 1(3.3%) | 1(4.0%) | 0 | 0.680 | |
| 前列腺增生症 | 7(23.3%) | 5(20.0%) | 6(30.0%) | 0.733 | |
| 格尔德 | 3(10%) | 2(8.0%) | 2(10.0%) | 0.961 | |
| 骨质疏松症 | 5(16.7%) | 5(20.0%) | 4(20.0%) | 0.936 | |
| 风湿性关节炎 | 1(3.3%) | 0 | 1(5.0%) | 0.561 | |
| 骨关节炎 | 7(23.3%) | 4(16.0%) | 5(25.0%) | 0.755 | |
| 糖尿病 | 3(10%) | 3(12.0%) | 2(10.0%) | 0.966 | |
| 高血压 | 7(23.3%) | 5(20.0%) | 5(25.0%) | 0.918 | |
| 血脂异常 | 16(53.3%) | 14(56.0%) | 12(60.0%) | 0.897 | |
| 缺血性心脏病 | 2(6.7%) | 1(4.0%) | 2(10.0%) | 0.725 | |
| 吸烟史 | 10(33.3%) | 8(32.0%) | 7(35.0%) | 0.978 | |
| 慢性药物 | |||||
| 反聚集 | 8(26.7%) | 6(24.0%) | 5(25.0%) | 0.974 | |
| ACE抑制剂/ ARB阻滞剂 | 6(20%) | 6(24.0%) | 6(30.0%) | 0.720 | |
| Beta阻滞剂 | 5(16.7%) | 5(20.0%) | 3(15.0%) | 0.901 | |
| 钙阻滞剂 | 3(10%) | 3(12.0%) | 2(10.0%) | 0.966 | |
| 阿尔法阻滞剂 | 7(23.3%) | 5(20.0%) | 6(30.0%) | 0.733 | |
| 利尿剂 | 2(6.7%) | 1(4.0%) | 1(5.0%) | 0.906 | |
| 他汀类 | 10(33.3%) | 9(36.0%) | 7(35.0%) | 0.978 | |
| 口服降糖 | 1(3.3%) | 1(4.0%) | 1(5.0%) | 0.958 | |
| 双膦酸盐 | 1(3.3%) | 1(4.0%) | 1(5.0%) | 0.958 | |
| 质子泵抑制剂 | 3(10%) | 3(12.0%) | 3(15.0%) | 0.726 | |
| 激素 | 3(10%) | 3(12.0%) | 2(10.0%) | 0.966 | |
| 苯二氮卓类 | 3(10%) | 2(8.0%) | 1(5.0%) | 0.816 | |
| 精神病研究所 | 5(16.7%) | 5(20.0%) | 3(15.0%) | 0.990 |
端粒长度
与基线相比,第30届会议和HBOT后T辅助端粒长度显着增加21.70±40.05(p = 0.042),23.69%±39.54(p = 0.012)和29.30±38.51(p = 0.005) )(图2)。但是,重复测量分析显示出不显着的趋势(F = 4.663,p = 0.06,表2和图2)。
表2. HBOT后端粒长度和衰老细胞的变化。
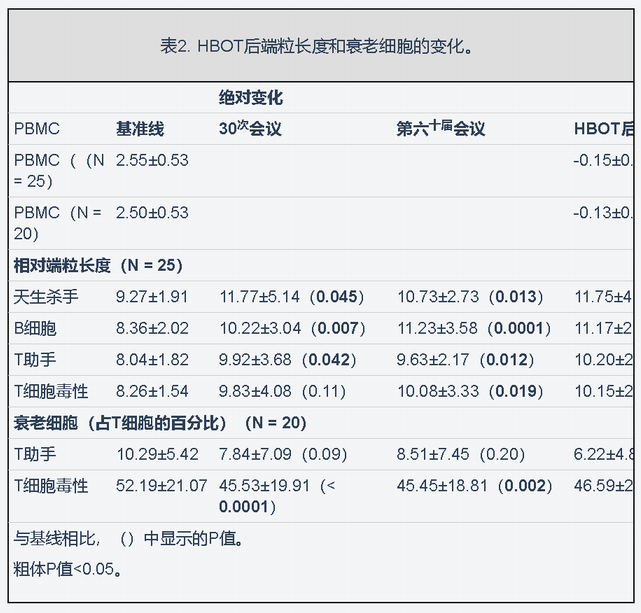
与基线相比,B细胞的端粒长度在30显著增加次会议上,60个会议和25.68%-HBOT交±40.42(p值= 0.007),29.39%±23.39(p值= 0.0001)和37.63%±52.73( p = 0.007)(图2)。重复测量分析显示了显着的组内效应(F = 0.390,p = 0.017,表2和图2)。
与基线相比,第30届会议(p = 0.045)和第60届会议的自然杀伤细胞端粒长度显着增加了20.56%±33.35(p = 0.013)。HBOT后,HBOT后端粒长度增加了22.16%±44.81(p = 0.06,表2和图2)。重复测量分析表明,在第30个疗程后没有其他显着影响(F = 0.812,p = 0.391)。
与基线相比,细胞毒性T细胞在第30届会议上没有显着增加,增幅为18.29%±45.62(p = 0.11),随后在第60届会议上显着增加了24.13%±40.88 (p = 0.0019) HBOT后为19.59%±33.98(p = 0.023)。重复测量分析表明,在第30个疗程后,没有其他明显的影响(F = 1.159,p = 0.310,表2和图2)。
衰老细胞
有在衰老T-辅助细胞的数量在30非显著下降个会话,并且60个分别由-19.66%±80.03(p值= 0.09)和-11.67%±94.30(p值= 0.20)会话。但是,HBOT后衰老的T辅助者数量显着下降-37.30%±33.04(P <0.0001,图3)。重复测量分析显示,即使在第30次治疗后仍具有显着的连续作用,并具有组内作用(F = 8.547,p = 0.01,表2和图3)。
在第30届HBOT会议上,T细胞毒性衰老细胞百分比显着下降-12.21%±8.74(P <0.0001),在第60届HBOT会议上(0.002)下降-9.81%±9.50和-10.96%±12.59(p = 0.0004) HBOT后)(表2和图3)。重复测量分析显示,即使在第30次治疗后仍具有显着的连续作用,具有组内效应(F = 6.916,p = 0.018,表2)。
HIF-1α
在第60届会议上,HIF-1alpha水平从10.54±3.39增加到19.71±3.39 (p = 0.006),其中HBOT后2周的水平为16.81±7.65,与基线无显着差异(p = 0.16)。
讨论
在这项研究中,首次在人类中发现,在老龄化人群中,每天重复进行HBOT疗程可使PBMC端粒长度增加20%以上,其中B细胞的变化最为显着。此外,HBOT使衰老细胞的数量减少了10-37%,其中T辅助衰老细胞受到的影响最大。
已经观察到端粒长度和生活方式改变之间的大量关联。这导致了几项干预性研究,包括饮食,补品(例如omega-3和核桃),体育锻炼,压力管理和社会支持。一项对认知健康的老年人进行的为期两年的试验,使用富含核桃的饮食,与对照饮食相比,保留端粒长度的趋势不明显[ 19 ]。在另一项评估对老年人进行十二周低频爆炸性抵抗训练的效果的研究中,干预组的端粒长度得到了更好的保留,而没有显着增加[ 20]。]。最近的一项研究发现,有氧耐力训练或六个月的高强度间歇训练可使端粒长度增加5%[ 21 ]。额外的减肥,瑜伽和压力管理技术未能显示端粒长度的显着变化[ 22 – 25 ]。然而,大多数这些研究已显示抗氧化活性和端粒酶活性[之间显著相关性22 – 25 ]。
尽管许多遗传和环境因素与端粒缩短有关,但最常见的提示机制是氧化应激。氧化应激可能是由于活性氧(ROS)与细胞清除剂的产生不平衡而引起的。端粒对氧化性DNA损伤高度敏感,后者可导致端粒缩短和功能障碍[ 26 ]。氧和/或氧化应激与端粒长度之间的关系在过去的几十年中一直存在争议。人类细胞培养研究一致表明,轻度的氧化应激会加速端粒缩短,而抗氧化剂和自由基清除剂会降低缩短速率并延长细胞增殖寿命[ 27]。对病理状况(例如糖尿病,炎性疾病,帕金森氏病)的一些临床研究表明,氧化应激标记,活性氧清除剂水平和端粒长度之间存在相关性[ 28 ]。然而,健康的个体没有显示出相似的结果[ 29 ]。
以前已经有人提出将细胞培养物暴露于高压环境中会诱导明显的氧化应激和过早的细胞衰老[ 30 ]。但是,这是基于高压培养箱中生长的分离细胞,而不是像本研究中那样基于人类的复杂生物系统。与目前的研究相似,先前对暴露于强高压氧的潜水者进行的为期一年的前瞻性观察研究显示,白细胞中端粒的伸长显着[ 31 ]。如在当前的研究中所使用的,高压氧协议利用由重复间歇高氧暴露致的影响,即所谓的高氧缺氧悖论[ 13,18]。这些间歇性的高氧暴露引起适应性反应,包括增加抗氧化剂基因的上调[ 32 ]和产生抗氧化剂/清除剂,以适应增加的ROS生成,从而导致ROS /清除剂的比例逐渐变得与正常氧气环境下的比例相似。但是,由于清除剂消除半衰期(T 1/2)明显大于ROS的T 1/2,因此在重复常高氧暴露后,恢复正常氧水平后,清除剂的水平显着提高,抗氧化活性提高[ 13],18]。因此,类似于体育锻炼和热量限制,每天重复进行HBOT协议可能会引起兴奋现象。单个曝光增加ROS产生剧烈,引发抗氧化反应,并用重复暴露,响应变得保护[ 13,18 ]。
另外,间歇性的高氧暴露引起许多在缺氧期间发生的生理反应[ 13 ]。HBOT诱导称为低氧诱导因子(HIF)的转录因子的释放,并增加其稳定性和活性[ 14 ]。反过来,HIF诱导细胞级联反应,包括血管内皮生长因子和血管生成诱导,线粒体生物发生,干细胞动员和SIRT1活性增加[ 18 ]。我们的研究证实,重复的HBOT暴露会诱导HIF表达增加,而在非单声环境下,HOT的水平会随着正常水平的降低而逐渐降低。
目前,在动物模型中已开发出许多通过遗传或药理学方法(衰老药)去除衰老细胞的干预措施,并正在等待人类的安全性和有效性评估[ 33 ]。当前的研究提出了一种非药理学方法,可用于减少衰老细胞数量的临床安全性概况。我们的协议包括在2 ATA进行60次100%的氧气处理,包括每次使用三个空气中断,以利用高氧低氧悖论并使氧气中毒的风险最小化。有趣的是,TL和衰老细胞减少峰值在30个会议。但是,与施加的压力,时间和HBOT暴露次数有关的剂量反应曲线及其与HIF表达及其相关的再生效应的关系仍不完全清楚,需要进一步研究以找到最佳的HBOT方案。
高压氧疗法是一种针对非愈合伤口,放射线损伤以及不同的缺氧或缺血事件(例如一氧化碳中毒,感染等)的行之有效的治疗方式。近年来,从临床前一个越来越多的证据以及临床试验表明高压氧用于治疗神经适应症,包括特发性突发性感觉神经性听力损失[功效34 ],卒中后和后创伤性脑损伤[ 35 – 41 ],中枢致敏综合征如纤维肌痛综合征[ 42,43 ]和年龄相关的认知衰退[ 17 ]和动物阿尔茨海默氏病的模型[ 44]。本研究首次旨在评估无任何功能受限疾病的衰老人类对细胞水平的生理影响。
研究局限性
当前的研究有几个局限性和需要考虑的优点。首先,必须考虑有限的样本量。第二,缺乏对照组。但是,这项研究表明,在TL和衰老细胞清除方面,令人印象深刻的结果在其他干预措施中均未观察到。此外,我们队列的基线端粒长度值与老龄化人群的预期值[ 45 – 47]。第三,效果的持续时间有待长期随访确定。第四,由于选择了用于血液保存和评估的方法,因此未评估端粒酶活性。但是,应该强调一些优势。在这项研究中,CD28用作衰老细胞的生物标志物,而CD57不能用作T细胞衰老的确认性标志物。在特定的白细胞群体上评估生物标志物,而不是将整个PBMC用作一组。对孤立的HBOT效果进行了测量,并对参与者进行了监控,以确保他们没有改变生活方式(如营养和运动),用药或任何其他可能造成混淆的干预措施。
总而言之,该研究表明,HBOT可以诱导明显的衰老作用,包括端粒长度的显着增加和衰老群体中衰老细胞的清除。
材料和方法
科目
入选了三十五名未发生病理性认知减退的成年人,年龄在64岁及以上,他们以良好的功能和认知状态独立生活。该研究在2016年至2020年之间在以色列的Shamir(Assaf-Harofeh)医疗中心进行。被纳入的患者在被纳入之前的最后一年没有心脏或脑血管局部缺血的病史。排除标准包括:在过去三个月中因任何原因先前接受过HBOT治疗,在过去一年中有任何恶性病史,任何病理性认知功能下降,严重的慢性肾衰竭(GFR <30),不受控制的糖尿病(HbA1C> 8,禁食)血糖> 200),免疫抑制剂,MRI禁忌症(包括BMI> 35),积极吸烟或肺部疾病。
学习规划
该研究方案已获得以色列沙米尔医学中心的机构审查委员会的批准。这项研究是一项前瞻性临床试验。签署知情同意书并进行基线评估后,将受试者分配到HBOT。在基线,治疗方案的一半(第30次治疗),最后一次HBOT治疗的当天以及HBOT治疗后1-2周评估测量点。
该研究队列仅包括接受HBOT治疗的患者,这是在以色列Shamir医学中心研究的较大的正常衰老人群的一部分(NCT02790541 [ 17 ])。
干预措施
HBOT协议在Multiplace Starmed-2700实验室(德国HAUX)中进行管理。该协议包括60个每日课程,三个月内每周五个课程。每节课包括在2ATA处通过口罩呼吸100%的氧气90分钟,每20分钟休息5分钟。压缩/减压速率为1米/分钟。在试验期间,不允许改变生活方式和饮食习惯,也不允许调整药物治疗。
血液样本
使用标准技术,在基线,HBOT方案的一半(第30个疗程),最后一次HBOT疗程的一天(第60个疗程)和术后1-2周将全血样品收集到EDTA试管中。上次HBOT会话。
外周血单核细胞(PBMC)分离
使用磷酸盐缓冲盐水(PBS)稀释全血。使用装满Lymphoprep的Leucosep管进行密度梯度分离。然后将试管在25°C下以1000x g离心10分钟。离心后,立即通过移液管收集细胞层(血沉棕黄层),并转移至50 mL锥形离心管中,用足够的1X PBS重悬至50 mL的体积,并在300x g下于25°C离心10分钟。除去上清液后,标记每个样品。
端粒长度
根据Dako PNA / FITC试剂盒规程(代码K5327)标记端粒。在由PBMC(样品细胞)和TCL 1301细胞系(对照细胞)的混合物组成的单细胞悬液中,在没有探针的杂交溶液存在下,在微量离心管中于82°C将DNA变性10分钟。在含有荧光素缀合的PNA端粒探针的杂交溶液中进行电泳。杂交在黑暗中在室温(RT)下进行过夜。杂交后,在40°C用洗涤溶液进行两次10分钟的杂交后杂交。然后在适当的缓冲液中用CD4 +,CD8 +,CD3 +,CD19 +和CD56 +缀合的抗体标记样品,以进行进一步的流式细胞术分析[ 48],49]。每个样品一式两份运行。流式细胞仪分析后,计算CD3 + / CD4 +(T-辅助),CD3 + / CD8 +(T-细胞毒性),CD3 + / CD56 +(天然杀伤力)和CD19 +(B细胞)的相对端粒长度(RTL)。将RTL值计算为每个样品的端粒信号与对照细胞(TCL 1301细胞系)之间的比率,并校正了G0 / 1细胞的DNA指数。使用碘化丙啶染色分别分析样品细胞和对照细胞的DNA倍性,以标准化每个细胞的端粒末端数,从而标准化每个染色体的端粒长度。有关FACS分析示例,请参见图4。
免疫分型
通过流式细胞术分析确定CD3 + CD4 + CD28-无效的T细胞(衰老的T辅助细胞)和CD3 + CD8 + CD28-无效的T细胞(衰老的T细胞毒性)的百分比。PBMC用VioBlue共轭抗CD3,Viogreen共轭抗CD8,PE-VIO 770A共轭抗CD4和APC-VIO 770A抗CD28抗体(Miltenyi Biotec)染色。用MACSQuant流式细胞仪(Miltenyi Biotec)分析细胞。然后计算CD4 +或CD8 + T细胞群中CD28null T细胞的百分比。
缺氧诱导因子(HIF-1alpha)
固定和通透化(Life Technologies)后,用APC偶联的抗HIF1a抗体或相应的同型对照(R&D系统)进行细胞内HIF1a染色。用MACSQuant流式细胞仪(Miltenyi Biotec)分析细胞,并确定表达HIF1a的PBMC的百分比。
统计分析
除非另有说明,否则连续数据表示为均值±标准差。使用Kolmogorov-Smirnov检验对所有变量的正态分布进行了检验。进行了单向方差分析,以比较基线时三组之间和之内的变量。
分类数据以数字和百分比表示,并通过卡方检验进行比较。使用Chi-Square / Fisher精确检验进行单变量分析,以识别显着变量(P <0.05)。
为了评估HBOT的作用,使用重复测量ANOVA模型来测试主要的受试者内作用。使用带有Bonferroni校正的t检验对方法进行事后检验,以检验时间差异。